Labor für Neurobiologie
Nervenzellen sind Spezialisten für Kommunikation. Sie nehmen Signale auf und geben Signale weiter, zum Beispiel an Muskelzellen oder an benachbarte Nervenzellen. Gewöhnlich werden die Signale über spezielle Botenstoffe vermittelt. Portionsweise in kleine Membranbläschen – die synaptischen Vesikel – verpackt, liegen die Signalmoleküle im Inneren der Nervenzellen bereit. Wenn elektrische Signale anzeigen, dass eine Botschaft übermittelt werden soll, verschmelzen einige synaptische Vesikel mit der Zellmembran und entleeren ihren Inhalt nach außen.
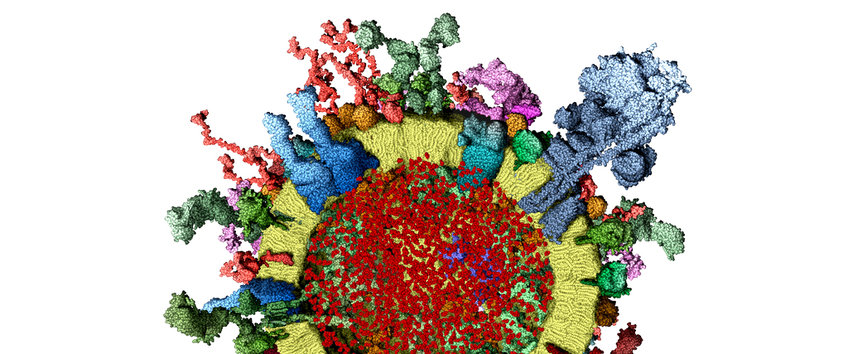
Synaptische Vesikel sind selbstständige Einheiten, deren molekularer Aufbau weitgehend aufgeklärt werden konnte. Sie enthalten Proteinmoleküle, die die Signale erkennen und die Membranen verschmelzen. Hierbei spielen spezielle Proteine, die sogenannten SNAREs, eine wichtige Rolle.
In unseren Arbeiten wollen wir herausfinden, wie die SNAREs in der Vesikel- und Zellmembran zusammenarbeiten, um die Membranen zu fusionieren. Inzwischen gibt es recht präzise Vorstellungen darüber: Wenn passende SNAREs miteinander in Kontakt treten und sich ineinander verhaken, verändern sie ihre Form. Anscheinend üben sie dabei eine solche Zugkraft aus, dass die Membranen, in denen sie verankert sind, einander extrem nahe kommen und verschmelzen. Diese Reaktion, die von zahlreichen anderen Proteinen kontrolliert wird, lässt sich im Reagenzglas nachstellen. Einer unserer Forschungsschwerpunkte besteht darin, die vielfältigen Faktoren, auf die es dabei ankommt, im Einzelnen zu untersuchen.
SNAREs spielen jedoch nicht nur bei der Fusion synaptischer Vesikel eine Rolle, sondern auch bei den vielfältigen Membranfusionen, die im Inneren jeder Zelle ablaufen. Biologische Membranen werden ständig umgebaut. Dabei schnüren sie kleine Bläschen ab, die sich dann in ein anderes Membransystem einfügen. Die Steuerung dieser SNAREs unterscheidet sich zum Teil erheblich: Schließlich sollen benachbarte Membranen nicht wahllos fusionieren. Nervenzellen zum Beispiel sollen ihre Botenstoffe nur dann ausschütten, wenn sie eine Nachricht zu übermitteln haben. Ein Teil unserer Forschungsarbeiten zielt darauf ab, Unterschiede und Gemeinsamkeiten dieser Prozesse herauszuarbeiten.
Um Neurotransmitter auszuschütten, müssen diese zunächst in die Vesikel hineingepumpt werden, was durch spezielle Proteine, die Neurotransmitter-Transporter, in der Membran synaptischer Vesikel bewirkt wird. Um die Arbeitsweise dieser Proteine besser zu verstehen, bauen wir diese Proteine in künstliche Vesikel ein und versorgen sie mit Energie, die für den Betrieb dieser Transporter erforderlich ist.


